Анализ особенностей обязательной маркировки лекарственных препаратов, ввозимых на территорию Российской Федерации
Худжатов Микаил Бекзадаевич
Аннотация: маркировка всех лекарственных препаратов, ввозимых на территорию Российской Федерации, станет обязательной с 1 июля 2020 г. В статье рассматриваются правила обязательной маркировки лекарственных препаратов, ввозимых на территорию РФ. Автором проводится анализ действующего законодательства РФ в области обязательной маркировки лекарственных препаратов, в результате которого определяются проблемы такой маркировки и предлагаются пути их решения.
Импорт медикаментов является одним из важнейших направлений внешней торговли Российской Федерации. Высокая значимость импорта медикаментов обусловлена необходимостью обеспечения населения РФ высококачественными лекарственными препаратами, в т.ч. жизненно важными медикаментами, аналоги которых не производятся в РФ [1].
По данным ФТС России в 2019 году стоимостные объемы импорта в РФ медикаментов, в т.ч. антибиотиков, составили около 10,7 млрд. долл. США (4,4% всего российского импорта), что на 30% больше их импорта за 2018 г.
Согласно ТН ВЭД ЕАЭС вся фармацевтическая продукция сосредоточена в 30-й товарной группе, состав которой показан в таблице 1. Всего в 2018 году импорт фармацевтической продукции в РФ составил 10,6 млрд. долл. США, 74% такого импорта приходится на лекарственные средства, расфасованные для розничной продажи. Всего импорт лекарственных средств в 2018 г. составил 8,1 млрд. долл. США (товарные позиции 3003-3004).
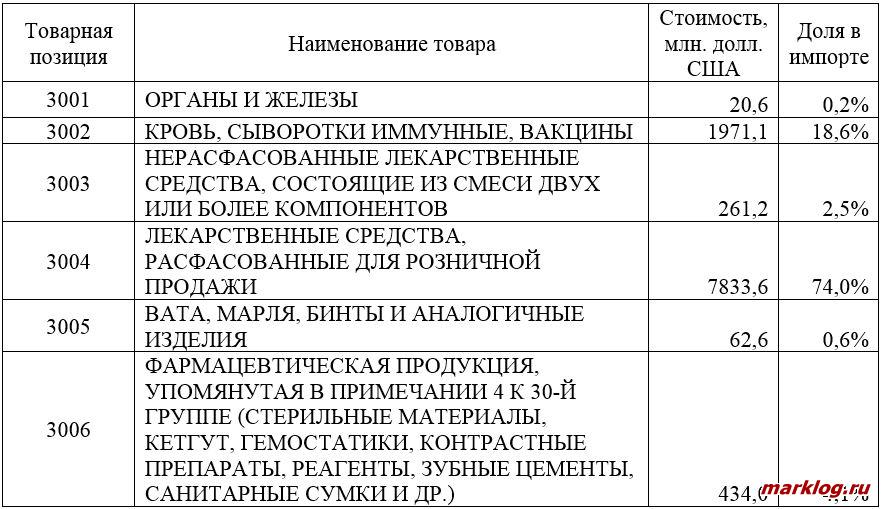
Таблица 1 — Структура фармацевтической продукции согласно ТН ВЭД ЕАЭС и ее импорт в РФ в 2018 году [2, 3]
Отметим при этом, что в товарную группу 30 по ТН ВЭД ЕАЭС не входят витамины (товарная позиция 2936), гормоны (товарная позиция 2937) и антибиотики (товарная позиция 2941), которые включены в товарную группу 29. Их импорт в 2018 г. составил 180,2, 122,2 и 129,3 млн. долл. США соответственно [2, 3].
В рамках настоящей статьи особое внимание уделяется лекарственным средствам, расфасованным в упаковки для розничной продажи (из товарной позиции 3004 по ТН ВЭД ЕАЭС), которые составляют основу импорта всех медикаментов на территорию РФ.
Основные страны – партнеры РФ по импорту вышеуказанных лекарственных средств: Германия, Франция, Италия, Индия, Швейцария, Великобритания, США, Словения (табл. 2).

Таблица 2 — Основные страны – партнеры РФ по импорту расфасованных лекарственных средств в 2018 г. [3]
Как правило, импорт лекарственных средств на территорию РФ подразумевает их выпуск для внутреннего потребления. В соответствии с положениями ст. 135 Таможенного кодекса ЕАЭС иностранные товары помещаются под процедуру выпуска для внутреннего потребления при условии уплаты таможенных платежей и соблюдения запретов и ограничений [4].
Поскольку маркировка товаров средствами идентификации относится к ограничениям, в целях их выпуска для внутреннего потребления на территории РФ данное условие должно быть соблюдено в обязательном порядке. Цель внедрения маркировки — противодействие производству и обороту контрафактной и фальсифицированной продукции.
В России лекарственные препараты начали маркировать с 2017 года в рамках эксперимента Правительства РФ. Пилотный проект проходил с февраля 2017 года по декабрь 2019, т.е. на подготовку отрасли к маркировке и прослеживанию отводилось 3 года [5].
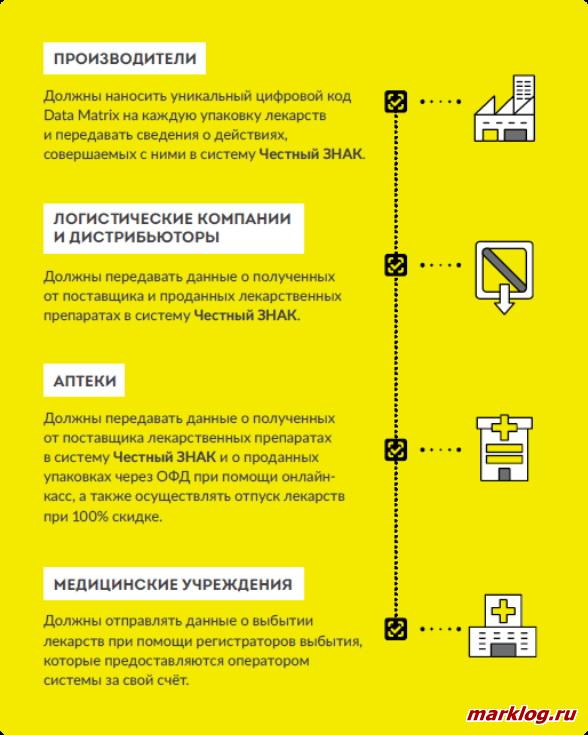
С 1 июля 2020 маркировка станет обязательной. Для этого на каждую пачку препарата будет нанесен штрих-код Data Matrix. Этот код содержит основную информацию о товаре. Отпуская товар, фармацевт в аптеке сможет проверить соответствие медикамента на корректность описания препарата в коде и на самом лекарственном средстве. Данные о препарате, срок производства и годности, информация о производителе будут храниться в системе Честный ЗНАК, что позволит избежать распространения поддельных лекарств [6].
Согласно положениям Закона от 12.04.2010 N 61-ФЗ для целей идентификации упаковок лекарственных препаратов производители наносят на первичную упаковку (если не предусмотрена вторичная упаковка) и вторичную упаковку лекарственных препаратов средства идентификации, за исключением лекарственных препаратов, производимых для клинических исследований, экспорта, лекарственных препаратов, не подлежащих государственной регистрации [7].
Юридические лица и индивидуальные предприниматели, осуществляющие ввоз на территории РФ лекарственных препаратов, обеспечивают внесение информации о лекарственных препаратах в систему мониторинга движения лекарственных препаратов. Вышеуказанные правила являются обязательными с 1 июля 2020 года [7]. Все участники оборота лекарственных препаратов показаны на рисунке 1.
Порядок обязательной маркировки лекарственных препаратов изложен в Постановлении Правительства РФ от 14.12.2018 N 1556. Так, под вводом в оборот на территории РФ лекарственных препаратов, произведенных за пределами ЕАЭС, подразумеваются операции, производимые с лекарственными препаратами от прохождения производственной стадии выпускающего контроля до завершения процедуры выпуска для внутреннего потребления при ввозе лекарственных препаратов в РФ [8].
Средства идентификации должны соответствовать характеристикам [8]:
а) двухмерный штрихкод наносится точечными символами Data Matrix;
б) двухмерный штрихкод наносится с уровнем класса качества C или выше;
в) штрихкод наносится печатью с использованием метода коррекции ошибок ЕСС-200;
г) при нанесении средства идентификации используется ASCII кодирование.
Код маркировки состоит из четырех групп данных [6]:
- обязательные данные от производителя: GTIN и серийный номер (14 и 13 символов соответственно);
- обязательные данные от оператора: ключ проверки (4 символа) и электронная подпись (крипточасть, 44 символа).
Получение средств идентификации от оператора системы мониторинга кодов маркировки осуществляется с использованием устройств регистрации эмиссии. Код запрашивается у оператора через регистратора эмиссии, а система выдает код в течение двух часов. Стоимость кода маркировки составляет 50 копеек без учета НДС [8].
Оператором системы является Центр развития перспективных технологий (ЦРПТ). Оператор системы обеспечивает в сети «Интернет» [9]:
а) размещение общедоступной информации на сайте системы мониторинга;
б) использование классификации и систематизированного поиска, предназначенного для анализа общедоступной информации.
В настоящее время 3 крупнейшие фармацевтические ассоциации подписали соглашение о сотрудничестве с ЦРПТ: Союз «Национальная Фармацевтическая Палата», Ассоциация аптечных учреждений «СоюзФарма», Ассоциация «Аптечная Гильдия». В рамках сотрудничества будут разработаны рекомендации для аптечных организаций по созданию стандартных операционных процедур для последовательного внедрения маркировки в бизнес-процессы. Информационной системой цифровой маркировки и прослеживания товаров является система «Честный ЗНАК».
В целях маркировки лекарственных препаратов импортеру следует [6]:
- Зарегистрироваться в системе «Честный ЗНАК». Для этого необходимо:
— оформить усиленную квалифицированную электронную подпись (УКЭП) на руководителя организации (список аккредитованных удостоверяющих центров ведется Минкомсвязью России);
— установить программное обеспечение для работы с УКЭП (программное обеспечение и инструкции предоставляет удостоверяющий центр, выдавший сертификат УКЭП);
— перейти на сайт https://mdlp.crpt.ru/ и зарегистрироваться;
- Описать лекарственные препараты в личном кабинете.
Сведения, представляемые в систему мониторинга о лекарственных препаратах, ввозимых на территорию РФ, указаны в третьем разделе Приложение N 3 к Положению.
- Получить устройство регистрации эмиссии.
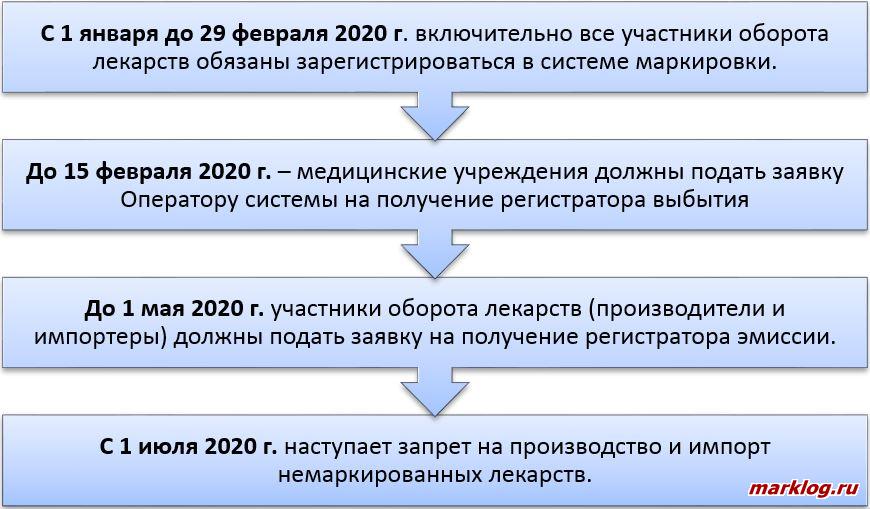
Оператор системы мониторинга обеспечивает получение импортерами кодов маркировки посредством оснащения устройствами регистрации эмиссии на безвозмездной основе [8]. В целях такого оснащения импортеры заключают с оператором системы мониторинга договоры. Основные этапы подключения к системе маркировки показаны на рисунке 2.
Необходимо отметить, что импортеры жизненно важных лекарственных препаратов обеспечивают их обязательную маркировку с 1 октября 2019 года [10]. Перечень жизненно важных лекарственных препаратов утвержден Распоряжением Правительства РФ от 12.10.2019 N 2406-р [11]. Жизненно важные лекарственные препараты, произведенные до 31 декабря 2019 года, а также иные лекарственные препараты, произведенные до 1 июля 2020 года, подлежат хранению, перевозке, отпуску, реализации, передаче, применению без нанесения средств идентификации до истечения срока их годности [7].
За продажу лекарственных препаратов без нанесения средств идентификации, с нарушением установленного порядка их нанесения, а также за несвоевременное внесение данных в систему мониторинга или внесение в нее недостоверных данных юридические лица и индивидуальные предприниматели с 1 июля 2020 года будут нести административную ответственность согласно ст. 6.33 и 6.34 КоАП РФ [12].
В целом, отметим, что введение обязательной маркировки лекарственных средств в перспективе будет препятствовать распространению поддельных лекарств, доля которых на российском рынке по оценкам экспертов доходит до 60-80%. Однако введение обязательной маркировки импортных лекарственных средств привело к возникновению ряда практических проблем.
Основная проблема связана с недостаточным уровнем готовности фармацевтической отрасли к обязательной маркировке лекарственных средств, что может привести к сбоям в поставках лекарственных препаратов. На логистических операторов возложена большая ответственность, поскольку операторы будут не просто обрабатывать грузы, попадающие на склад, но и массив данных, содержащих всю информацию о маркированной продукции. Крупные операторы уже заявили о невозможности своевременных поставок лекарственных препаратов с 1 января 2020 г. в связи с необходимостью обновления программного обеспечения.
По этой причине логистические операторы вынуждены адаптировать систему управления складом (WMS), а также стандартные операционные процедуры. Существуют и другие задачи: закупка и/или модернизация оборудования для сканирования, агрегирования до уровня короба или паллеты.
Другая проблема связана с местом организации нанесения кодов маркировки. Как показывает практика, наиболее эффективным способом является нанесение маркировки непосредственно на производстве. Однако зачастую иностранные поставщики (особенно в Европе) не желают заниматься дополнительной маркировкой продукции, перекладывая данную задачу на плечи покупателя. Покупатель, в свою очередь, стремится получить разрешение у таможенных органов наносить маркировку на складе временного хранения (СВХ) после прибытия груза. Однако согласно положениям Таможенного кодекса ЕАЭС маркировка товаров на СВХ запрещена, такие операции могут совершаться на таможенном складе. При этом если СВХ имеется вблизи почти каждого таможенного поста, то количество таможенных складов даже в Москве и Московской области сильно ограничено [13, 14].
С учетом планомерного увеличения категорий товаров, подлежащих обязательной маркировке, целесообразно внести изменения в ст. 102 ТК ЕАЭС, дополнив ее возможностью нанесения обязательной маркировки на иностранные товары в пределах территории СВХ.
Наконец, в целях единообразного понимания требований обязательной маркировки необходимо юридически точно определить понятие термина «лекарственный препарат», а также привести перечень лекарственных препаратов в соответствии с ТН ВЭД ЕАЭС[15].
Таким образом, цифровая маркировка должна внести существенный вклад в государственное регулирование оборота лекарственных препаратов на территории РФ. Внедрение обязательной маркировки позволит повысить эффективность противодействия обороту нелегальных лекарственных препаратов [16]. При этом имеющиеся проблемы на практике должны быть решены в кратчайшие сроки, в т.ч. за счет реализации предложенных в статье рекомендаций, в целях обеспечения бесперебойных поставок лекарственных препаратов на российский рынок.
Список использованной литературы:
- Войтенко Б.А. Импорт и экспорт лекарств как одно из ключевых направлений развития фармацевтической промышленности в России // World Science: Problems and Innovations: сборник статей XXIV Международной научно-практической конференции. 2018. С. 75-78.
- Решение Совета Евразийской экономической комиссии от 16.07.2012 N 54 «Об утверждении единой Товарной номенклатуры внешнеэкономической деятельности Евразийского экономического союза и Единого таможенного тарифа Евразийского экономического союза» // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Официальный сайт Федеральной таможенной службы Российской Федерации: [Электронный ресурс]. Режим доступа: http://www.customs.ru/index.php (дата обращения: 27.01.2020).
- Таможенный кодекс Евразийского экономического союза (приложение N 1 к Договору о Таможенном кодексе Евразийского экономического союза) // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Официальный сайт ООО «Оператор-ЦРПТ»: [Электронный ресурс]. Режим доступа: https://crpt.ru/ (дата обращения: 27.01.2020).
- Маркировка лекарств: [Электронный ресурс]. Режим доступа: https://xn--80ajghhoc2aj1c8b.xn--p1ai/business/projects/medicines/ (дата обращения: 27.01.2020).
- Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Постановление Правительства РФ от 14.12.2018 N 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Постановление Правительства РФ от 14.12.2018 N 1558 «Об утверждении Правил размещения общедоступной информации, содержащейся в системе мониторинга движения лекарственных препаратов для медицинского применения, в информационно-телекоммуникационной сети «Интернет» (в том числе в форме открытых данных)» // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Постановление Правительства РФ от 14.12.2018 N 1557 «Об особенностях внедрения системы мониторинга движения лекарственных препаратов для медицинского применения» // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Распоряжение Правительства РФ от 12.10.2019 N 2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2020 год, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи» // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Кодекс Российской Федерации об административных правонарушениях от 30.12.2001 N 195-ФЗ // СПС «Консультант Плюс» (дата обращения: 27.01.2020).
- Худжатов М.Б. Антикризисное управление в сфере околотаможенных услуг // Стратегии бизнеса. 2017. № 8 (40). С. 32-37.
- Худжатов М.Б., Адамова О.В. Актуальные проблемы внешнеэкономической деятельности при совершении таможенных операций // Экономические стратегии ЕАЭС: проблемы и инновации: сборник материалов Всероссийской научно-практической конференции. 2018. С. 176-184.
- Арский А.А. Проблемы защиты прав на объекты интеллектуальной собственности таможенными органами // Вестник Московского гуманитарно-экономического института. – 2018. – №4. – с. 16-20.
- Арский А.А. Ценообразование во внешней торговле // Вестник Московского финансово-юридического университета. – 2018. – № 3. – с. 42-46.
УДК 339.562
Худжатов М. Б. – кандидат экономических наук, доцент кафедры таможенного дела Российского университета дружбы народов, Москва, Россия
e-mail: mikailkhudzhatov@mail.ru
Analysis of the features of mandatory marking of foreign medicines imported into the territory of the Russian Federation
Khudzhatov M. – candidate of economic sciences, associate professor of the department of customs management of the Peoples’ Friendship University of Russia (RUDN University), Moscow, Russia
Annotation: The marking of all medicines imported into the territory of the Russian Federation will become mandatory on July 1, 2020. The article discusses the rules for the mandatory marking of medicines imported into the territory of the Russian Federation. The author analyzes the current legislation of the Russian Federation in the field of mandatory marking of medicines, as a result of which the problems are identified and ways to solve them are proposed.
При цитировании статьи в других источниках просим использовать следующий формат: Худжатов М. Б. Анализ особенностей обязательной маркировки лекарственных препаратов, ввозимых на территорию Российской Федерации // Маркетинг и логистика. – 2020. – №1 (27). — с. 63-75.
Полная версия журнала в pdf-формате по ссылке «Маркетинг и логистика».